
Modèle des objets de santé (MOS)
Cette partie présente le dispositif médical tel que défini dans le règlement (UE) 2017/745 du parlement européen et du conseil du 5 avril 2017.
Tous les dispositifs certifiés par ce règlement doivent porter un identifiant unique (IUD) et être enregistrés dans la base européenne EUDAMED
L'entité juridique liée au dispositif médical représente le fabricant du dispositif.
Remarque : Les classes non déployées, c'est à dire celles dont les attributs sont masqués, sont décrites dans d'autres parties (ou packages).
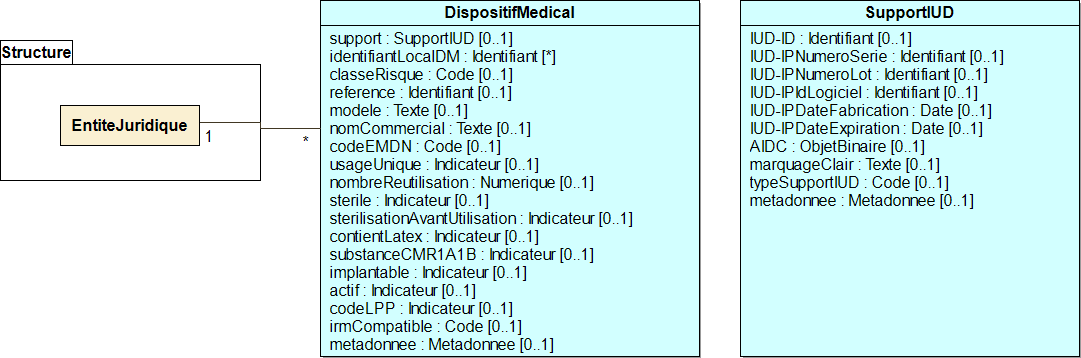
Figure 15 Diagramme de classe DispositifMedical
Liste des classes |
|---|
L’article 2 partie 1 du Règlement (UE) 2017/745 du 5 avril 2017 définit un dispositif médical (DM) comme tout instrument, appareil, équipement, logiciel, implant, réactif, matière ou autre article, destiné par le fabricant à être utilisé, seul ou en association, chez l'homme pour l'une ou plusieurs des fins médicales précises suivantes:
** diagnostic, prévention, contrôle, prédiction, pronostic, traitement ou atténuation d'une maladie,
** diagnostic, contrôle, traitement, atténuation d'une blessure ou d'un handicap ou compensation de ceux-ci,
** investigation, remplacement ou modification d'une structure ou fonction anatomique ou d'un processus ou état physiologique ou pathologique,
** communication d'informations au moyen d'un examen in vitro d'échantillons provenant du corps humain, y compris les dons d'organes, de sang et de tissus,
et dont l'action principale voulue dans ou sur le corps humain n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de tels moyens.
Les produits ci-après sont également réputés être des dispositifs médicaux :
** les dispositifs destinés à la maîtrise de la conception ou à l'assistance à celle-ci,
** les produits spécifiquement destinés au nettoyage, à la désinfection ou à la stérilisation des dispositifs visés à l'article 1er, paragraphe 4, et de ceux visés au premier alinéa du présent point.
Mise en correspondance FHIR R4: Device et DeviceDefinition
Mise en correspondance OMOP V5.4: Device_exposure
Liste des attributs de la classe DispositifMedical
Nom | Description |
|---|---|
Le support IUD est la manière dont l'IUD est communiqué grâce à l'AIDC et, le cas échéant, son marquage en clair.
Parmi les supports IUD, on trouve notamment les codes à barres unidimensionnels ou linéaires, les codes à barres à deux dimensions/code QR, les identifiants RFID. | |
Identifiants affectés au dispositif médical dans les référentiels locaux. Mise en correspondance FHIR R4: Device.identifier | |
Classe de risque du dispositif. Les dispositifs sont répartis en classe I, classe IIa, classe IIb et classe III en fonction de la destination des dispositifs et des risques qui leur sont inhérents. La classification est effectuée conformément à l'annexe VIII du Règlement (UE) 2017/745. | |
Référence du dispositif médical ou numéro dans le catalogue commercial. Mise en correspondance FHIR R4: DeviceDefinition.identifier | |
Modèle du dispositif médical. Mise en correspondance FHIR R4: DeviceDefinition.modelNumber | |
Dénomination commerciale du modèle du dispositif médical. Mise en correspondance FHIR R4: DeviceDefinition.deviceName.name | |
Code du modèle du dispositif médical dans la nomenclature EMDN (European Medical Device Nomenclature). | |
Indicateur pour spécifier si le dispositif est à usage unique.
1 : dispositif à usage unique
0 : dispositif réutilisable Mise en correspondance FHIR R4: DeviceDefinition.property | |
Le nombre limité de réutilisations du dispositif médical. Mise en correspondance FHIR R4: DeviceDefinition.property | |
Indicateur pour spécifier si le dispositif est stérile.
1 : dispositif stérile
0 : dispositif non stérile Mise en correspondance FHIR R4: DeviceDefinition.property | |
Indicateur pour spécifier si le dispositif doit être stérilisé avant utilisation.
1 : stérilisation nécessaire
0 : stérilisation non nécessaire Mise en correspondance FHIR R4: DeviceDefinition.property | |
Indicateur pour spécifier si le dispositif contient du latex.
1 : contient du latex
0 : ne contient pas de latex Mise en correspondance FHIR R4: DeviceDefinition.safety | |
Indicateur pour spécifier si le dispositif contient des substances CMR de catégorie 1A ou 1B.
1 : contient des substances CMR de catégorie 1A ou 1B
0 : ne contient pas de substances CMR de catégorie 1A et 1B Mise en correspondance FHIR R4: DeviceDefinition.safety | |
Indicateur pour spécifier si le dispositif est implantable.
1 : dispositif implantable
0 : dispositif non implantable Mise en correspondance FHIR R4: DeviceDefinition.property | |
Indicateur pour specifier si le dispositif est actif.
L’article 2 partie 4 du Règlement (UE) 2017/745 du 5 avril 2017 définit les dispositifs actifs comme "tout dispositif dont le fonctionnement dépend d'une source d'énergie autre que celle générée par le corps humain à cette fin ou par la pesanteur et agissant par modification de la densité de cette énergie ou par conversion de celle-ci. Les dispositifs destinés à la transmission d'énergie, de substances ou d'autres éléments, sans modification significative, entre un dispositif actif et le patient ne sont pas réputés être des dispositifs actifs. Les logiciels sont aussi réputés être des dispositifs actifs."
1 : dispositif actif
0 : dispositif non actif Mise en correspondance FHIR R4: DeviceDefinition.property | |
Code de la Liste des Produits et des Prestations (LPP) du modèle du dispositif médical.
Il s'agit d'un code national utilisé pour obtenir le remboursement par l'Assurance Maladie de certains DM (implantables ou invasifs non implantables) en sus des prestations d’hospitalisations à l’hôpital, ou le remboursement de certains produits et prestations en ville. | |
La norme ASTM (American Society for Testing and Materials ) F2503 distingue 3 niveaux de compatibilité IRM d’un dispositif médical :
‒ « MR Safe » (IRM compatible sans conditions) : dispositifs pouvant être introduits dans tout type d’IRM sans risque (matériau non conducteur, non métallique, non magnétique) ;
‒ « MR Unsafe » (non IRM compatible) : dispositifs engendrant un risque pour le patient lors de son introduction dans l’IRM ;
‒ « MR Conditional » (IRM compatible sous conditions) : dispositifs pouvant être introduits dans l’IRM sous des conditions précises pré spécifiées par le fabricant. Seul le respect de toutes ces conditions pourra permettre la réalisation d’une IRM sans risque. Cela revient à évaluer les conditions dans lesquelles un dispositif médical n’est pas dangereux dans un environnement à résonance magnétique.
La FDA recommande que tous les Dispositifs Médicaux Implantables Actifs (DMIA) soient classés « MR Conditional » (IRM compatible sous conditions) ou « MR Unsafe » (non IRM compatible) selon les cas, compte tenu de la présence de composants électroniques conducteurs. Autrement dit, un DMIA ne doit jamais être considéré comme « MR Safe ».
La création de la nomenclature associée est en cours. Mise en correspondance FHIR R4: DeviceDefinition.safety | |
Informations relatives à la gestion des classes et des données. |
Le support IUD (transcription AIDC et marquage en clair de l'IUD) est apposé sur l'étiquette ou sur le dispositif proprement dit et sur tous les niveaux de conditionnement supérieurs du dispositif. Les conteneurs de transport ne font pas partie des niveaux de conditionnement supérieurs.
L’article 27 partie 3 du Règlement (UE) 2017/745 du 5 avril 2017 définit le système d'identification unique des dispositifs (IUD).
Ce système permet l'identification et facilite la traçabilité des dispositifs autres que les dispositifs sur mesure et les dispositifs faisant l'objet d'une investigation.
La production d'un IUD comprenant:
** un identifiant «dispositif» IUD (IUD-ID), propre à un fabricant et à un dispositif ;
** un identifiant «production» IUD (IUD-IP), qui identifie l'unité de production du dispositif et, le cas échéant, les dispositifs conditionnés.
Liste des attributs de la classe SupportIUD
Nom | Description |
|---|---|
L'IUD-ID est l’identifiant du dispositif qui a été introduit par les règlements pour identifier un modèle ou une famille de dispositifs et qui apparaît sur les certificats et les déclarations de conformité UE. Ce code est également la principale clé d’accès aux registres d’informations liées aux produits dans la base de données EUDAMED contenant l'ensemble des informations liées aux dispositifs médicaux sur le marché européen.
L'IUD-ID est un code numérique ou alphanumérique unique propre à un modèle de dispositif qui sert également de clé d'accès aux informations stockées dans une base de données IUD. Mise en correspondance FHIR R4: Device.udiCarrier.deviceIdentifier Mise en correspondance OMOP V5.4: Device_exposure.unique_device_id | |
Numéro de série du DM.
Au sein d'un lot de fabrication, un DM peut être affecté d'un numéro de série unique permettant une meilleure traçabilité.
Après l'entrée en application du Règlement (UE) 2017/745, le numéro de série constitue un type d’IUD-IP. L’affectation d’un numéro de série est obligatoire pour les DMI actifs marqués CE au titre du règlement. Mise en correspondance FHIR R4: Device.serialNumber Mise en correspondance OMOP V5.4: Device_exposure.production_id | |
Numéro du lot auquel appartient le DM.
Après l'entrée en application du Règlement (UE) 2017/745, le numéro de lot du DM constitue un type d’IUD-IP. L’affectation d’un numéro de lot ou d’un numéro de série est obligatoire pour les DMI marqués CE au titre du règlement. Mise en correspondance FHIR R4: Device.lotNumber Mise en correspondance OMOP V5.4: Device_exposure.production_id | |
Identifiant du logiciel.
L'IUD est attribué au niveau du système du logiciel. Seuls les logiciels qui sont disponibles en soi dans le commerce et ceux qui constituent un dispositif à part entière sont soumis à cette exigence.
L'identification du logiciel est considérée comme un mécanisme de contrôle de la fabrication et est indiquée dans l'IUD-IP. Mise en correspondance FHIR R4: Device.lotNumber Mise en correspondance OMOP V5.4: Device_exposure.production_id | |
Après l'entrée en application du Règlement (UE) 2017/745, la date de fabrication constitue un type d’IUD-IP. Mise en correspondance FHIR R4: Device.manufactureDate Mise en correspondance OMOP V5.4: Device_exposure.production_id | |
Après l'entrée en application du Règlement (UE) 2017/745, la date d’expiration constitue un type d’IUD-IP. Mise en correspondance FHIR R4: Device.expirationDate Mise en correspondance OMOP V5.4: Device_exposure.production_id | |
Identification et saisie automatiques des données (AIDC - Automatic identification and data capture).
L'AIDC est une technologie utilisée pour procéder à la capture automatique de données. Les techniques concernées sont notamment les codes à barres, les cartes à puce, la biométrie et l'identification par radiofréquence (RFID).
S'il est fait usage de codes à barres linéaires, l'IUD-ID et l'IUD-IP peuvent être concaténés ou non concaténés en deux codes à barres ou plus. Toutes les parties et tous les éléments du code à barres linéaire sont reconnaissables et identifiables.
Si le fabricant recourt à la technologie RFID, un code à barres linéaire ou à deux dimensions conforme à la norme prévue par les entités d'attribution apparaît également sur l'étiquette. Mise en correspondance FHIR R4: Device.udiCarrier.carrierAIDC | |
Le marquage en clair est une interprétation lisible des caractères d'information encodés dans le support IUD.
En anglais HRI : Human Readable Interpretation Mise en correspondance FHIR R4: Device.udiCarrier.carrierHRF | |
Type de technologie AIDC : code à barres, 1D, 2D ou RFID Mise en correspondance FHIR R4: Device.udiCarrier.entryType | |
Informations relatives à la gestion des classes et des données. |
